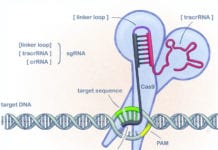
När gensaxen Crispr/Cas9 blev världskänd för sju-åtta år sedan målades ganska snart bilden upp av ett verktyg med vilket man enkelt kunde bota en rad svåra genetiska sjukdomar. Och visst pågår det kliniska studier – men de är inte många och inte stora. Än.
– En stor utmaning är att nå rätt vävnad med behandlingen, säger Bernhard Schmierer, chef för faciliteten High throughput genome engineering, HTGE, på Scilifelab i Solna.
Det är därför inte överraskande att några av de första kliniska studierna med Crispr/Cas9 i världen görs för behandling av blodsjukdomar respektive en ögonsjukdom. I båda fallen handlar det om att korrigera en väldefinierad mutation samtidigt som det är relativt ”lätt” att nå det önskvärda målet.
Förbättrar syretransporten
Den ena studien, som pågått sedan förra året, sker på patienter med den ärftliga blodsjukdomen beta-thalassemi. Sjukdomen orsakas av mutationer i en gen som är viktig i bildandet av hemoglobin och finns i olika svårighetsgrader. I den svåraste formen drabbas patienterna av kronisk blodbrist som kräver upprepade blodtransfusioner och ibland stamcellstransplantation.
I studien som genomförs i Kanada, Tyskland och Storbritannien ingår 12 patienter i åldern 18-35 år. Från patienterna utvinns hematopoetiska stamceller (det vill säga de stamceller ur vilka blodceller bildas) som i labbet behandlas så att de producerar höga nivåer av så kallat fetalt hemoglobin (HbF).
Fetalt hemoglobin är en form av syrebärande hemoglobin som finns vid födseln, men som sedan ersätts av vuxenformen av hemoglobin (som inte fungerar som det ska hos patienter med beta-thalassemi).
Själva modifieringen av av de utvunna cellerna görs med Crispr/Cas9 och innebär att genen som kodar för HbF uppregleras genom att en transkriptions-repressor knockas ut. De behandlade cellerna återförs sedan till patienten med en injektion i blodet, där de förväntas fortsätta dela sig och fungera som syrebärare tillräckligt bra för att patienterna ska slippa blodtransfusioner.
Med samma läkemedelskandidat (CTX001) genomför forskarna även en liknande studie fast med patienter med blodsjukdomen sicklecellanemi. Även sicklecellanemi är en ovanlig och ärftlig sjukdom som beror på en mutation i hemoglobigenen. I denna studie ingår 45 patienter mellan 18 och 35 år och på liknande sätt som i beta thalassemi-studien utvinns hematopoetiska stamceller som efter korrigering återförs till patienterna igen.
Stoppar nedbrytning
I en studie som görs i USA testas Crispr-tekniken för behandling av patienter med den ärftliga och ovanliga ögonsjukdomen Lebers kongenitala amauros, LCA. LCA är en grupp av nedärvda sjukdomar (beroende på vilken gen som är påverkad), som påverkar näthinnan och som innebär att synen gradvis försämras. Det är också den främsta orsaken till medfödd blindhet.
Ungefär 18 patienter, både vuxna och barn med en specifik mutation, ska ingå i studien som just har startat. I stället för att ta ut celler från patienten och modifiera dem i labbet och sedan återföra dem, sprutas i denna studie ett virus med de genmodifierande komponenterna (det vill säga gensaxen) in i ögat för att korrigera den defekta genen. Förhoppningen är att viruset där ska infektera så många celler som möjligt med den korrigerande gensaxen.
– Äen om gensaxen har gett nya möjligheter att behandla genetiska sjukdomar innebär den sannolikt ingen bot än så länge utan snarare grader av förbättring. För någon som är blind och som efter behandling kanske kan göra skillnad på natt och dag är det dock en stor förbättring. Resultaten från dessa kliniska ses fram mot med stor förväntan, säger Bernhard Schmierer.
Andra sjukdomar där Crispr ofta nämns som potentiell behandling, och där mycket forskning pågår, är cystisk fibros, Huntingtons sjukdom, spinal muskelatrofi och hiv. Men i vissa fall, som i den neurologiska sjukdomen Huntingtons, är det svårt att nå fram med behandlingen. Sjukdomen beror på en mutation i en enda gen, som visserligen gör den lämplig för korrigering med Crispr/Cas9, men det är en utmaning att på ett säkert och effektivt sätt förmedla läkemedel och genterapier till centrala nervsystemet.
Letar nya måltavlor
För Bernhard Schmierer och forskarkollegan Jenna Persson på Scilifelab är det dock grundforskning som gäller. En stor del av arbetet handlar om screening av olika slag för att förstå olika geners roll vid till exempel utveckling av cancer.
– Om man i en population av celler knockar ut alla gener en för en och behandlar cellerna med ett visst läkemedel kan man se vilka celler som överlever och därmed vilka gener som kan vara måltavlor för nya läkemedel, säger Bernhard Schmierer.
På HTGE arbetar man också med att ta fram cellinjer med olika mutationer skapade med Crispr/Cas9 åt andra forskare. Det kan till exempel handla om en cancercellinje där man vill klippa bort eller föra in DNA för att sedan se hur den påverkas vid behandling med olika substanser.
Med Crispr/Cas9 kan man också aktivera en felaktigt avstängd gen. När genen slås på kan den till exempel producera ett korrekt protein som det annars varit brist av och som orsakat sjukdom.
– Vi kan också mutera vissa proteinkodande sekvenser i DNA:t och se vad som är viktigt för att en viss läkemedelsmolekyl ska interagera med proteinet, säger Jenna Persson.
Oftast arbetar forskarna på HTGE med kommersiella humana cellinjer, men även med cellinjer från möss och från enstaka patienter.
Varför har inte den kliniska forskningen med Crispr/Cas9 kommit längre?
– Jag tycker att den har kommit långt. Tekniken har inte ens funnits i tio år så det är snabbt att det redan pågår kliniska prövningar. Kanske har det gått för snabbt till och med?
Bernhard Schmierer nämner det faktum att man ännu vet väldigt lite om eventuella biverkningar och långtidseffekter med tekniken.
– Det kan handla om klipp på fel ställen i genomet. Det skulle till exempel kunna få allvarliga konsekvenser om man råkade klippa i och avaktiverar en tumörsupressorgen.
Utvecklas snabbt
Men tekniken utvecklas hela tiden och som Läkemedelsvärlden rapporterade i en tidigare artikel om Crispr/Cas9 har amerikanska forskare utvecklat ett verktyg kallat ”prime editing” som bara klipper av den ena DNA-strängen, vilket gör det mer förlåtande för eventuella felklipp. Tekniken gör det också mycket mer effektivt att föra in nya sekvenser i DNA:t.
Hur långt tror du den kliniska användningen av Crispr/Cas har kommit om tio år?
– Det är svårt att säga för Crispr-tekniken utvecklas i rasande fart. Jag tror att svårigheten att leverera läkemedlet i kroppen kommer att återstå. Det har alltid varit ett problem och en utmaning för all genterapi och egentligen för alla läkemedel.
Var tycker du gränsen går för vad man kan göra med Crispr i människa?
– Det är solklart, man ska inte förändra i mänskliga könsceller. Så fort man gör det har man gått över en gräns och den gränsen ska inte passeras, säger Bernhard Schmierer.
I dag är genterapi i behandlande syfte, bland annat med hjälp av Crispr/Cas9, tillåten om det är kroppsceller som modifieras – så kallad somatisk genterapi. I dessa fall tillförs de genetiska förändringarna endast den enskilda individen och går inte i arv.
Enligt svensk lagstiftning får man dock inte göra försök i forsknings- eller behandlingssyfte som innebär att genetiska förändringar går i arv till nästa generation. Genetiska försök kan dock genomföras på mänskliga befruktade ägg, men som längst till 14 dagar efter befruktningen. De modifierade äggen får heller inte föras in i en kvinnas livmoder.
En av upptäckarna av Crispr/Cas9, Emmanuelle Charpentier, tilldelas i år Apotekarsocietetens vetenskapliga pris Scheelepriset. Prisutdelningen äger rum den 28 november i samband med Scheelesymposiet – en heldag med fokus på den senaste forskningen inom Crispr/Cas9-området och med framförande av bland annat Emmanuelle Charpentier. Här kan du läsa mer om och anmäla dig till dagen.