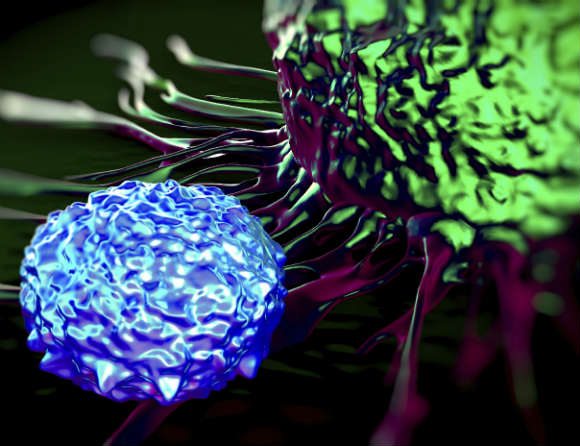
EU:s läkemedelsmyndighet EMA rekommenderar via sin expertkommitté CHMP ett villkorat marknadsgodkännande för CAR-T-terapin Tecartus (brexucabtagene autoleucel). Det innebär att en tredje CAR-T-terapi mot svåra fall av cancer nu är på väg ut på marknaden i Europa.
Godkännandet ska enligt CHMP:s rekommendation gälla behandling av vuxna med en ovanlig cancerform som drabbar vita blodkroppar och kallas mantelcellslymfom. CHMP ger klartecken för användning till patienter som fått återfall i mantelcellslymfom eller inte har svarat på minst två andra systemiska behandlingar.
Tecartus första CAR-T mot mantelcellslymfom
CAR-T-terapier bygger på att vita blodkroppar (T-celler) tas ut från patienten och modifieras genetiskt så att de kan känna igen och döda en viss typ av cancerceller. De modifierade cellerna förs tillbaka till patienten och bekämpar cancersjukdomen.
EU-kommissionen har, som Läkemedelsvärlden rapporterat, tidigare godkänt två andra CAR-T-terapier. Den ena mot två andra former av lymfom hos vuxna och den andra mot leukemi hos barn och en form av lymfom hos vuxna.
Tecartus blir den första CAR-T-terapin som EU-godkänns mot mantelcellslymfom. Sjukdomen är en aggressiv undertyp av non-Hodgkins lymfom. Nuvarande standardbehandling innefattar bland annat terapi med hjälp av patientens egna stamceller. Behandlingarna ger ofta effekt, men det är tyvärr vanligt med återfall och att cancern så småningom blir resistent mot behandlingen.
Tecartus marknadsförs av företaget Kite pharma, ett dotterföretag till amerikanska Gilead sciences. Tecartus är en engångsbehandling. När produkten tidigare i år fick godkännande i USA skrev nyhetssajten Biopharmadive att Gileads listpris på behandlingen för en patient var 373 000 US-dollar, ungefär 3,3 miljoner kronor.
Godkännande ska villkoras
Säkerhet och effekt hos Tecartus studerades i en klinisk multicenterstudie där 74 patienter med mantelcellslymfom fick behandlingen på grund av återfall eller behandlingsresistens. De följdes i 12 månader. Hos 84 procent krympte tumören och hos 59 procent konstaterades fullständig respons, det vill säga att alla tecken på cancer var borta.
Den vanligaste biverkningen av behandlingen är så kallat ”cytokine release syndrome”, CRS. Detta är en immunreaktion som orsakar feber och influensaliknande symtom och även kan leda till en hjärninflammation. Det är ett livshotande tillstånd och CHMP föreskriver noggrann information riskerna i produktinformationen om Tecartus.
Att godkännandet villkoras innebär att företaget behöver komma in med ytterligare data om säkerhet och effekt efter godkännandet.