Vid sitt senaste möte rekommenderade EMA:s vetenskapliga kommitté CHMP godkännande för åtta läkemedel, varav sex var helt nya substanser.
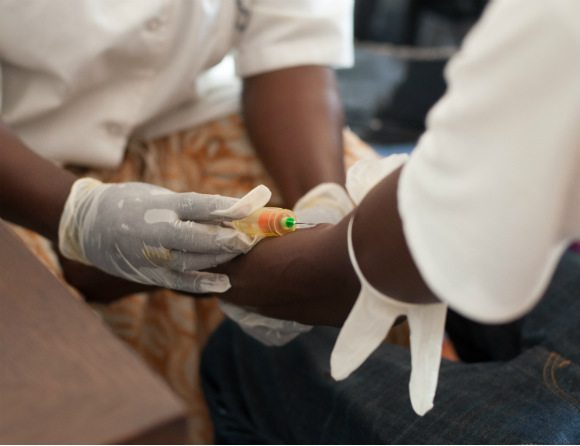
Bland de nya substanserna fanns ett nytt ebolavaccin – det andra i ordningen. Det första vaccinet mot ebola, Ervebo, godkändes i EU i november förra året.
Det nya vaccinet består av två komponenter, Zabdena och Mvabea, som ges vid olika tillfällen. Först ges Zabdena och efter ungefär åtta veckor ges Mvabea som en boosterdos. Med tanke på att vaccinet ges i två steg är det enligt CHMP inte lämpligt för användning om en omedelbar effekt önskas.
Ebolavaccin för personal
I ett pressmeddelande skriver CHMP också att ytterligare en boosterdos av Zabdena bör övervägas till personer med medelhög risk att utsättas för ebolaviruset om det var mer än fyra månader sedan de fullföljde vaccinering med Zabdena/Mvabea. Det kan till exempel handla om hälso- och sjukvårdsarbetare och de som besöker eller lever i områden med ett pågående ebolautbrott.
Det är ännu inte känt exakt hur starkt skydd vaccinet ges men i kliniska studier på mer än 3 300 personer har vaccinet visats kunna skapa ett immunsvar mot ebolaviruset. Det bedöms också säkert och de vanligaste biverkningarna var smärta, värme och svullnad kring injektionsstället, trötthet, huvudvärk, muskelvärk, ledvärk och frossa.
Ebola är en ovanlig men allvarlig virussjukdom. Mellan 25 och 90 procent som drabbas av sjukdomen dör. I det hittills största utbrottet i Västafrika 2014-2016 dog mer än 11 000 personer. I nuläget pågår ett ebolautbrott i Demokratiska republiken Kongo där hittills 3 400 personer har bekräftats smittade. Av dem har 67 procent avlidit till följd av sjukdomen.
Nytt mot hepatit D
Vid CHMP:s majmöte rekommenderades även ett nytt läkemedel mot kronisk hepatit D godkännande. I dagsläget saknas behandling mot hepatit D och det nya läkemedlet, Hepcludex (bulevirtide) godkändes enligt EMA:s så kallade Prime-förfarande. Det innebär att företaget bakom läkemedlet och EMA haft en tidig och tät kontakt under godkännandeproceduren för att läkemedlet på så sätt ska nå patienterna snabbare.
CHMP rekommenderade även godkännande för Piqray (alpelisib) för behandling bröstcancer med en så kallad PIK3CA-mutation.
Ytterligare två nya substanser fick tummen upp av CHMP. Cancerläkemedlet Rozlytrek (entrectinib) rekommenderades godkännande dels för behandling av patienter med solida tumörer med en specifik förändring i genen för neurotrofiskt tropomysinreceptorkinas, NTRK, och dels för patienter med ROS1-positiv, avancerad icke småcellig lungcancer.
Även läkemedlet Xenleta (lefamulin) fick positivt utlåtande för behandling av vuxna patienter med samhällsförvärvad pneumoni.