EU:s nya reglering av medicintekniska produkter ska enligt planerna träda i kraft 26 maj i år. Men nu meddelar EU-kommissionen att den vill skjuta fram startskottet för det nya regelverket ett år.
– Genom denna åtgärd vill vi minska trycket på nationella myndigheter och på industrin. Detta för att de ska kunna fokusera på de akuta prioriteringarna i relation till coronakrisen, sade Stefan De Keersmacker, en talesperson för kommissionen, i ett videoinspelat pressmeddelande.
Övergångstid för medicinteknik snart slut
Helena Dzojic, enhetschef på Läkemedelsverkets enhet för medicinteknik, välkomnar EU-kommissionens besked.
– Att vi får ett extra år på oss underlättar för tillverkarna, för oss och för övriga aktörer. Det var ett bra beslut, säger hon.
Redan för tre år sedan antog EU-parlamentet, som Läkemedelsvärlden rapporterade, den nya förordningen. Den ska ersätta de tidigare reglerna för medicintekniska produkter inom EU.
Formellt började förordningen att gälla 2017. Medlemsländerna fick dock en övergångsperiod på sig för att anpassa sig till de nya bestämmelserna. Men den 26 maj i år skulle de börja tillämpas fullt ut.
Många nya regler
De nya reglerna innebär bland annat skärpta kvalitets- och säkerhetskrav på en del medicintekniska produkter och delvis en mer ingående tillsyn. Exempelvis ställer den nya förordningen högre krav på granskningen av medicintekniska produkter innan de släpps ut på marknaden.
Den granskningen görs av en tredje part, ”anmält organ” (notified body), som måste ha en viss klinisk expertis. Granskningen ska också följa nya riktlinjer.
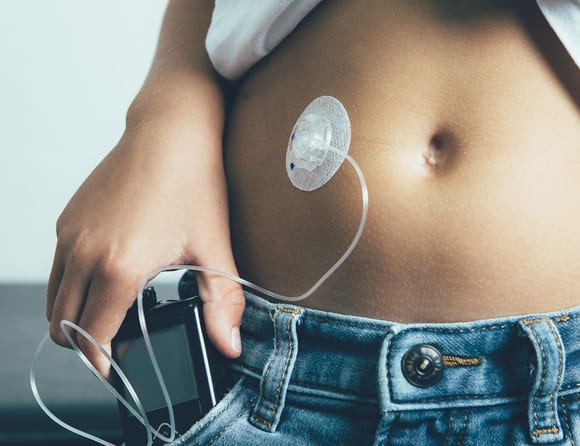
För implantat och produkter som administrerar läkemedel, exempelvis insulinpumpar, måste även en oberoende expertpanel granska det anmälda organets bedömning innan produkten får CE-märkas och släppas ut på marknaden.
En annan förändring är att alla tillverkare och medicintekniska produkter måste registreras i en gemensam europeisk databas, EUDAMED, som dock ännu inte är färdig.
Tidskrävande anpassning
Dessa är bara några av alla nyheter som branschen, myndigheterna och EU under övergångstiden har arbetat med att anpassa sig till. De har i olika forum under resans gång varnat för att det kan bli svårt att hinna med alla förändringar. Ett omdiskuterat problem har till exempel varit att i tid få klart med godkända anmälda organ.
I slutet av 2019 fick medlemsländerna i uppdrag att kolla hur långt anpassningen kommit. Skulle den bli klar till startdatum för den nya förordningen 26 maj 2020?
Svaret kom i en lägesrapport som visade att flera av förändringarna riskerade att bli försenade. Och då hade ännu inte effekterna av coronakrisen börjat märkas fullt ut.
– Vi låg redan lite på gränsen när det gäller att hinna med anpassningen och sedan kom påverkan av covid-19, förklarar Helena Dzojic.
Pandemin påverkar branschen
Covid-19-pandemin har skapat ett stort tryck på delar av medicinteknikindustrin. Företag arbetar för högtryck med att försöka tillgodose vårdens ökade behov av bland annat skyddsutrustning, respiratorer och utrustning för provtagning.
Reserestriktioner och andra åtgärder för att begränsa smittspridningen försvårar också arbetet med anpassning till de nya medicinteknikreglerna.
Branschen och nationella myndigheter har därför efterfrågat en senareläggning av det datum då förordningen ska börja tillämpas fullt ut. Något som EU-kommissionen nu alltså tagit till sig. Kommissionen planerar att senast i början av april lägga fram ett förslag om att flytta fram startdatum för de nya bestämmelserna ett år.
– Vi uppmanar rådet och EU-parlamentet att anta förslaget snabbt eftersom deadline för den nuvarande övergångsperioden är i slutet av maj, sade kommissionens talesperson Stefan De Keersmaecker.
Ingen paus
Helena Dzojic förklarar att Läkemedelsverket för närvarande analyserar vad senareläggningen mer i detalj kan betyda för myndigheten och övriga svenska aktörer. Vissa delar av anpassningen till den nya förordningen har redan genomförts och ska fortsätta att fungera på det nya sättet. Det gäller till exempel förändringar i rapporteringen om säkerhetsproblem med medicintekniska produkter.
Men i huvudsak innebär senareläggningen att aktörerna får fortsätta att arbeta enligt nuvarande lagstiftning ett år till.
– Det är dock viktigt att komma ihåg att det inte handlar om någon paus för aktörernas arbete med anpassning till den nya förordningen, säger Helena Dzojoc.
– Det gäller för alla att använda det extra året på ett klokt sätt och fortsätta anpassningen så att vi verkligen är redo om ett år.